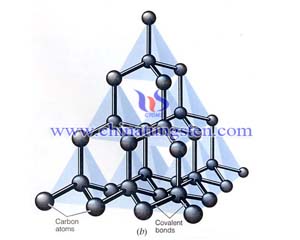
碳化矽的結構

碳化矽是由碳原子和矽原子以共價鍵為主相結合而構成的化合物。共價鍵是四種基本的鍵型(離子鍵、共價鍵、金屬鍵、分子鍵)中結合力最強的一種,再加上碳原子與矽原子相互作用成鍵時,發生了電子在殼層上的轉移,形成了鍵能更為堅強的SP3雜化軌道,這就是碳化矽形成類金剛石的結構、具有很高的硬度和熔點的原因。
碳原子的電子層結構是C,1s22s22p2,即它的外層電子有四個,其中兩個是2s電子,兩個是2p電子。2s次層只有一個軌道,這兩個2s電子都在這個軌道上,惟自旋相反。2p次層可以有三個軌道,分別記為2px、2py、2pz。所以碳原子的外層有四個軌道,即2s。2px,2py、2pz。電子在這四種軌道上運動時,2s軌道的電子雲分佈式球形對稱,2p軌道有點像啞鈴形狀。2px2py2pz的形狀一樣,只是分佈的方向不同,它們分別順著x、y、z、三軸的方向分佈。 就有四個未成對的價電子,與外界可以形成四個共價鍵。2S電子激發到2Pz軌道雖然要花費能量,但這樣可以形成兩個共價鍵,可以得到更多的結構。這就說明了為什麼碳原子可以是四個共價鍵。碳原子中的四個價電子,有一個2s電子式球形對稱的,另外三個2p電子是互相垂直的。當這四個價電子與外界聯繫形成四個共價鍵時,是否有三個共價鍵是互相垂直的,而另一個是任意方向的呐?事實上不是這樣的。

理論和時間都可以說明,當C原子與外界形成四個共價鍵時它外層的四個軌道(2S,2Px,2Py,2Pz)要互相混合重新組成四個等同的新軌道,稱為雜化軌道sp3。這四個雜化軌道的方向是指向正四面體的四角,其電子雲分佈式集中在四面體中心與四個頂角之間,分成四個相同的分支。這樣的雜化軌道稱為四面體雜化軌道,與外界時,要盡可能按四面體的結構來成鍵。碳化矽是由碳原子和矽原子以共價鍵為主相結合而構成的化合物。共價鍵是四種基本的鍵型(離子鍵、共價鍵、金屬鍵、分子鍵)中結合力最強的一種,再加上碳原子與矽原子相互作用成鍵時,發生了電子在殼層上的轉移,形成了鍵能更為堅強的SP3雜化軌道,這就是碳化矽形成類金剛石的結構、具有很高的硬度和熔點的原因。
碳原子的電子層結構是C,1s22s22p2,即它的外層電子有四個,其中兩個是2s電子,兩個是2p電子。2s次層只有一個軌道,這兩個2s電子都在這個軌道上,惟自旋相反。2p次層可以有三個軌道,分別記為2px、2py、2pz。所以碳原子的外層有四個軌道,即2s。2px,2py、2pz。電子在這四種軌道上運動時,2s軌道的電子雲分佈式球形對稱,2p軌道有點像啞鈴形狀。2px2py2pz的形狀一樣,只是分佈的方向不同,它們分別順著x、y、z、三軸的方向分佈。 就有四個未成對的價電子,與外界可以形成四個共價鍵。2S電子激發到2Pz軌道雖然要花費能量,但這樣可以形成兩個共價鍵,可以得到更多的結構。這就說明了為什麼碳原子可以是四個共價鍵。碳原子中的四個價電子,有一個2s電子式球形對稱的,另外三個2p電子是互相垂直的。當這四個價電子與外界聯繫形成四個共價鍵時,是否有三個共價鍵是互相垂直的,而另一個是任意方向的呐?事實上不是這樣的。理論和時間都可以說明,當C原子與外界形成四個共價鍵時,它外層的四個軌道(2S,2Px,2Py,2Pz)要互相混合重新組成四個等同的新軌道,稱為雜化軌道sp3。這四個雜化軌道的方向是指向正四面體的四角,其電子雲分佈式集中在四面體中心與四個頂角之間,分成四個相同的分支。這樣的雜化軌道稱為四面體雜化軌道,與外界時,要盡可能按四面體的結構來成鍵。





